Natalie_Chem wrote:
Химфак:)
Надеюсь, что химфак СПбГУ, а не какой-нибудь шарашкиной конторы? Ну ладно, поехали.Natalie_Chem wrote:
1) Определите pH раствора уксусной кислоты, если степень диссоциации ее в этом растворе составляет 2 %. Константа диссоциации 1,8*10^-5.
Вообще-то для решения этой задачи нужна концентрация, а раз она не задана, то либо 1) доцент тупой, либо 2) ее можно найти по косвенным данным. Вариант 1) отвергаем по вышеизложенным причинам и обращаем свое внимание на закон разведения Оствальда в приближенной форме:Ka =
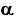 2 c, откуда находим с = Ka /
2 c, откуда находим с = Ka / 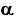 2 = 1,8*10-5 / 0,022 = 0,045 (моль/л)
2 = 1,8*10-5 / 0,022 = 0,045 (моль/л)pH = -lg
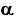 c = - lg (0,02*0,045) = 3,05.
c = - lg (0,02*0,045) = 3,05.Если хотим более точно, то записываем точную формулу закона Оствальда и решаем квадратное уравнение. 2% - это как раз близко к грани. Считаем ли мы, что 0,98 в знаменателе то же, что единица? Для учебных целей - всегда считаем.
Natalie_Chem wrote:
Вычислите pH 10^-8 M раствора бромоводородной кислоты. Константа диссоциации 10^8.
Если использовать формулу pH = –lg CHBr, то получится парадоксальный результат: pH = 8, т.е.при разбавлении кислоты раствор стал щелочным! Это происходит потому, что в ней не учитывается собственная диссоциация воды, из-за которой в чистой воде [H+] = 10–7 моль/л и pH = 7. Добавление пусть даже такого малого количества сильной кислоты смещает это равновесие влево. Пусть равновесная концентрация [OH–] = x моль/л, тогда [H+] = x+10–8 моль/л и ионное произведение воды можно представить в виде:
(x + 10–8) * x = 10–14,
откуда х = 9,5 * 10–8, [H+] = 1,05 * 10–7 моль/л и pH = 6,98.
Константа диссоциации здесь не нужна, уж очень она большая, так что недисоциированной HBr можно пренебречь. И по абсолютному значению, и по сравнению с другими литературными данными (по косвенным данным говорят, что около 103-104, что не отменяет - пренебрегаем и 0,000001, и 0,01, и 0,1 % якобы недиссоциированной кислоты).




