Attachment:
разные соединения меди.
| Форум Химиков - Энтузиастов. Химия и Химики http://www.chemistry-chemists.com/forum/ |
|
| Медь и ее соединения http://www.chemistry-chemists.com/forum/viewtopic.php?f=1&t=325 |
Page 12 of 14 |
| Author: | Volodymyr [ 31 Jul 2023 19:33 ] |
| Post subject: | Re: Медь и ее соединения |
Attachment: разные соединения меди. |
|
| Author: | Volodymyr [ 02 Aug 2023 13:07 ] |
| Post subject: | Re: Медь и ее соединения |
Attachment: Quote: Added an excess of ammonia to a copper sulfate solution. Bottom layer is CuSO4, Middle precipitated layer is Cu(OH)2 and top layer is Cu(NH3)4(H2O)n]SO4.
|
|
| Author: | alexandrio [ 20 Aug 2023 14:19 ] |
| Post subject: | Re: Медь и ее соединения |
Хлорид меди можно получить и без использования соляной кислоты. Взаимодействием меди с азотной кислотой в присутствии хлорида аммония: Cu + NH4Cl + HNO3 => CuCl2 + H2O + NO^ + N2^ Добавлял азотную кислоту прямо к сухой смеси медных тонких проводов и хлорида аммония. Но лучше использовать вдобавок маточный раствор от предыдущего синтеза, или раствор хлорида меди. |
|
| Author: | Volodymyr5 [ 21 Aug 2023 00:39 ] |
| Post subject: | Re: Медь и ее соединения |
Меня немного смущает, что аммоний останется - азотная кислота его в растворе не окислит. Хлорид аммония может дать с хлоридом меди двойную соль, что-то вроде (NH4)2[CuCl4]. |
|
| Author: | alexandrio [ 21 Aug 2023 19:10 ] |
| Post subject: | Re: Медь и ее соединения |
Была серия опытов: 1) Смешивал растворы NH4Cl и HNO3, и далее нагревал. Выделялся бесцветный газ и пахло хлором. 2) К сухой смеси медных тонких проводов и хлорида аммония прикапывал азотную кислоту. Поначалу выделялся бурый газ. После появления жидкой фазы начал греть суспензию. При дальнейшем прикапывании азотки выделялся бесцветный газ. 3) В 13 % соляной кислоте растворил окись меди. В образовавшемся растворе хлорида меди растворил хлорид аммония. Далее насыпал медные провода. Раствор из зелёного перешёл в бурый цвет. И далее начал прикапывать к горячей смеси азотку. Тут же выделялся бесцветный газ... В итоге получилось некоторое количество кристаллов зелёного цвета правильной формы. То, что кристаллы получились правильной формы, это смущает уже меня, ибо пишут, что хлорная медь двухводная кристаллизуется в виде палочек, иголок. Азотная кислота ион аммония не окисляет, это да. Чего не скажешь о продуктах неполного восстановления нитрат-ионов. Промежуточные нитрит-ионы окисляют аммоний ещё как. В след. раз замерю плотность маточного раствора после выделения зелёных кристаллов. Это хоть что-то даст. |
|
| Author: | moonshine43 [ 21 Aug 2023 19:57 ] |
| Post subject: | Re: Медь и ее соединения |
Если растворить окись меди в соляной кислоте, уже получится хлорид меди 2. Если его мало, можно добавить туда же проводов, солянки и подождать. В таком растворе медь дополнительно растворяется очень охотно, добавлять лишние ионы совершенно не нужно. |
|
| Author: | alexandrio [ 21 Aug 2023 20:52 ] |
| Post subject: | Re: Медь и ее соединения |
Хочу избежать длительного упаривания раствора CuCl2, содержащего некоторое количество соляной кислоты. И это удалось! Да и не так уж и много остаётся лишних ионов. Нетрудно посчитать, сколько воды нужно упарить, например, при взаимодействии 15 % соляной кислоты с медью и каким-нибудь окислителем или окисью меди. А то, что Cu+ может окисляться относительно быстро и воздухом, это интересно. В ближайшее время проведу ещё опыты. |
|
| Author: | Volodymyr [ 21 Aug 2023 21:13 ] |
| Post subject: | Re: Медь и ее соединения |
alexandrio wrote: А то, что Cu+ может окисляться относительно быстро и воздухом, это интересно. Растворяется ли медь в соляной кислоте? / Does copper dissolve in hydrochloric acid? http://chemistry-chemists.com/N1_2018/C ... -P1-1.html Раствор солянки - медная проволока на дне - неплотно закрытая бутылка (воздух над раствором + постепенный приток). Через сутки сверху - коричневый раствор (хлоридный комплекс меди II), снизу - бесцветный раствор (хлоридный комплекс меди I).   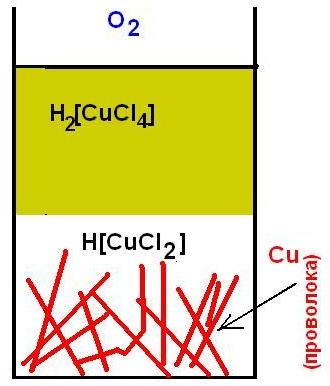 Если будет приток воздуха и периодическое перемешивание - медь постепенно растворится. Проблема: HCl будет лететь навстречу (в помещение). Если бутылку заполнить соляной кислотой полностью и герметично закрыть, результат - бесцветный раствор. Т.е., без воздуха медь не будет растворяться. P.S. Делал много лет назад - пишу по памяти. По возможности - сделаю снова и пересниму (т.к. тогда фотографировал на камеру, которая давала слабое разрешение). |
|
| Author: | moonshine43 [ 21 Aug 2023 22:23 ] |
| Post subject: | Re: Медь и ее соединения |
Медь отлично растворяется не то, что в солянке, а в столовом 5% уксусе. Мне тут недавно понадобился в качестве фунгицида раствор соли меди( фактически любой). Из реактивов только соль, сода, уксус и лимонная кислота. Взял пластиковый стаканчик, положил проволоку ( еле нашёл  ) ,залил уксусом и затянул плёнкой. Раз- два в день помешивал. Через неделю тёмно-синий раствор. Надо было снять, конечно.. если придётся повторить - сниму. ) ,залил уксусом и затянул плёнкой. Раз- два в день помешивал. Через неделю тёмно-синий раствор. Надо было снять, конечно.. если придётся повторить - сниму.
|
|
| Author: | alexandrio [ 22 Aug 2023 11:04 ] |
| Post subject: | Re: Медь и ее соединения |
В таблице приведены концентрации кислот в %, при которых после барботирования воздуха через медный лом получаются растворы солей, насыщенных при 25 и 90 °C без учёта выноса паров воды (а может и паров кислот) при барботаже. Attachment: tab.png [ 3.24 KiB | Viewed 4338 times ] * - это фантастический вариант, ** - при 75 °C. Возможно в качестве катализатора следует вносить небольшое количество соляной кислоты (в промышленности используется Fe2+/Fe3+), например 5 % от эквивалентного количества кислоты. Получается, самый простой вариант - H2SO4 при 25 °C. |
|
| Author: | antabu [ 22 Aug 2023 11:13 ] |
| Post subject: | Re: Медь и ее соединения |
Кристаллы CuCl2 синего цвета. В качестве окислителя для получения хлорной меди из разбавленной солянки лучше взять пергидроль, но добавлять постепенно, по ходу реакции из делительной воронки. |
|
| Author: | alexandrio [ 22 Aug 2023 11:40 ] |
| Post subject: | Re: Медь и ее соединения |
Хмм... тоже вариант. Только в случае 34 % пергидроля и 20 % солянки получается 25 % раствор CuCl2, который для кристаллизации надо упарить примерно наполовину... |
|
| Author: | alexandrio [ 22 Aug 2023 21:27 ] |
| Post subject: | Re: Медь и ее соединения |
Пробовал растворять CuO в солянке 36 %, предварительно охлаждённой в морозильнике. Замечательно растворяется, аки сахар в воде. И раствор получился насыщенным при высокой температуре. Вот только он спонтанно кристаллизовался по всему объёму. Всё-таки тяжко без затравочных кристаллов. В итоге суспензию обратно растопил в колбе, предварительно зачерпнув отдельно немного кашицы в качестве затравочных кристаллов. Надеюсь, в этот раз получится. Солянки такой концентрации осталось не так много, поэтому попытаюсь получить ещё некоторое количество хлорной меди другим способом. |
|
| Author: | antabu [ 23 Aug 2023 06:24 ] |
| Post subject: | Re: Медь и ее соединения |
У меня такое впечатление, что хлорную медь проще купить, чем соляную кислоту. Используется при травлении печатных плат. |
|
| Author: | alexandrio [ 04 Sep 2023 17:14 ] |
| Post subject: | Re: Медь и ее соединения |
Отжатая от маточного раствора хлорная медь: Attachment: Attachment: Маточный раствор которого использавал для получения тетрахлорокупрата аммония: Attachment: Для сравнения цветов на след. фото есть маточный раствор тетрахлорокупрата: Attachment: А этот маточный раствор в свою очередь хочу использовать для получения того же тетрахлорокупрата, но с использованием аммония хлористого, медных проводов и азотки. Предыдущие эксперименты показали, что азотка реагирует с медью именно при мольном отношении 2:1 в присутствии хлорида аммония: Cu + 2NH4Cl + 2HNO3 --> CuCl2 + NH4NO3 + 3H2O + N2^. Добавлять реагенты буду согласно уравнению Cu + 4NH4Cl + 2HNO3 --> (NH4)2CuCl4 + NH4NO3 + 3H2O + N2^. |
|
| Author: | Volodymyr [ 11 Sep 2023 12:32 ] |
| Post subject: | Re: Медь и ее соединения |
Lake water and copper sulfate - p.8 http://chemistry-chemists.com/N3_2023/C ... -P7-4.html Attachment:
|
|
| Author: | alexandrio [ 24 Sep 2023 11:05 ] |
| Post subject: | Re: Медь и ее соединения |
На фото - хлорная медь 2-водная. Получил обменкой между 46 % раствором CaCl2 и 36 % раствором CuSO4 и последующим упариванием отжатого от гипса 27 % раствора CuCl2. Attachment: Выход - 26 %. Остальные 74 % остались в маточном растворе (в банке) и водно-спиртовом растворе (в стаканчике), который получился при промывке отжатых кристаллов ледяным спиртом (-20 °C). |
|
| Author: | antabu [ 28 Sep 2023 06:12 ] |
| Post subject: | Re: Медь и ее соединения |
В киоске на базаре. Снято через стекло. Attachment:
|
|
| Author: | Volodymyr [ 04 Oct 2023 19:55 ] |
| Post subject: | Re: Медь и ее соединения |
Попробовал взаимодействие медной проволоки в колбе с разбавленной уксусной кислотой (50 мл воды - 10 мл уксусной кислоты). Над раствором в колбе большой объем воздуха. Прошло 6 дней - голубой окраски раствора незаметно. Единственное заметное изменение - участок проволоки, который оказался над поверхностью раствора, почернел. При погружении его в раствор черный цвет исчез. |
|
| Author: | alexandrio [ 04 Oct 2023 20:11 ] |
| Post subject: | Re: Медь и ее соединения |
Похоже нужен катализатор, например в виде железного гвоздика. |
|
| Page 12 of 14 | All times are UTC [ DST ] |
| Powered by phpBB © 2000, 2002, 2005, 2007 phpBB Group http://www.phpbb.com/ |
|